ऊष्मा भौतिकी का एक महत्वपूर्ण विषय है, जो वस्तुओं के बीच ऊर्जा के आदान-प्रदान को समझाता है। यह ऊर्जा का ऐसा रूप है, जो तापमान में वृद्धि या कमी लाने का कार्य करता है।
विगत वर्षों में पूछे गए प्रश्न
| वर्ष | प्रश्न | अंक |
| 2016 | ऊष्मागतिकी के प्रथम नियम के उपपरिणामस्वरूप हेस के नियम को उपयुक्त उदाहरणों सहित बताइए। | 2M |
ऊष्मा और तापमान का परिचय
तापमान क्या है?
- तापमान किसी पदार्थ में अणुओं की औसत गतिज ऊर्जा का माप है। यह एक सापेक्ष माप है, जिसका अर्थ है कि कोई वस्तु किसी अन्य चीज़ की तुलना में केवल “गर्म” या “ठंडी” होती है।
- सेल्सियस (°C), फ़ारेनहाइट (°F) और केल्विन (K) में मापा जाता है।
- उदाहरण: उबलते पानी का तापमान बर्फ़ से ज़्यादा होता है क्योंकि इसके अणु तेज़ी से चलते हैं।
ऊष्मा क्या है?
- ऊष्मा ऊर्जा का एक रूप है जो तापमान के अंतर के कारण वस्तुओं के बीच स्थानांतरित होती है।
- यह गर्म से ठंडे की ओर तब तक प्रवाहित होती है जब तक कि तापीय संतुलन नहीं हो जाता।
- जूल (J) या कैलोरी (cal) में मापा जाता है।
- उदाहरण: जब आप चाय के गर्म कप को छूते हैं, तो कप से आपके हाथ में ऊष्मा प्रवाहित होती है।
ऊष्मा की इकाइयाँ:
- जूल (J) – ऊष्मा की SI इकाई।
- कैलोरी (कैलोरी) – 1 ग्राम पानी के तापमान को 1°C बढ़ाने के लिए आवश्यक ऊष्मा की मात्रा।
- 1 कैलोरी = 4.186 जूल
- अर्ग ।
- 1 जूल = 107 अर्ग
तापमान की इकाइयाँ:
- सेल्सियस (°C) – पानी के हिमांक (0°C) और क्वथनांक (100°C) पर आधारित।
- फ़ारेनहाइट (°F) – कुछ देशों में उपयोग किया जाता है, जिसका हिमांक 32°F और क्वथनांक 212°F होता है।
- केल्विन (K) – SI इकाई, परम शून्य 0 K (सबसे कम संभव तापमान) है।
- रोमर पैमाना – इस पैमाने पर जल का हिमांक 0°R तथा जल का क्वथनांक 80°R है। उनके बीच के भाग को 80 बराबर भागों में बाँट देते हैं।
- रूपांतरण सूत्र:
- °C= 5/9 (°F−32)
- °F= 9/5 (°C) + 32
- K= °C + 273.15
केल्विन तापमान पैमाना
- लॉर्ड केल्विन द्वारा परिभाषित।
- परम शून्य को 0 K के रूप में लिया जाता है।
- केल्विन पैमाना सेल्सियस पैमाने से सीधे संबंधित है:
T(K)= t(°C) + 273.15- 0°C = 273.15 K
- 100°C = 373.15 K
तापमान पैमानों की तुलना
| पैमाना | पानी का हिमांक | पानी का क्वथनांक | परम शून्य |
| सेल्सियस (°C) | 0°C | 100°C | -273.15°C |
| केल्विन (K) | 273.15 K | 373.15 K | 0 K |
| फ़ारेनहाइट (°F) | 32°F | 212°F | -459.67°F |
ऊष्मा और तापमान के बीच अंतर
| गुण | ऊष्मा | तापमान |
| परिभाषा | तापांतर के कारण स्थानांतरित ऊर्जा | आणविक गतिज ऊर्जा का माप |
| SI इकाई | जूल (J) | केल्विन (K) |
| प्रकृति | गर्म से ठंडे की ओर प्रवाहित होता है | प्रवाहित नहीं होता |
| उपकरण | कैलोरीमीटर | थर्मामीटर |
तापमान का मापन
- थर्मामीटर: पारा या अल्कोहल के विस्तार का उपयोग करता है। {लिक्विड-इन-ग्लास थर्मामीटर}
- डिजिटल थर्मामीटर: सटीक रीडिंग के लिए इलेक्ट्रॉनिक सेंसर का उपयोग।
- इन्फ्रारेड थर्मामीटर: संपर्क के बिना तापमान मापते हैं, चिकित्सा और औद्योगिक अनुप्रयोगों में उपयोग किए जाते हैं।
क्लिनिकल थर्मामीटर
शरीर के तापमान को मापने के लिए क्लिनिकल थर्मामीटर का उपयोग किया जाता है।
क्लिनिकल थर्मामीटर की विशेषताएँ:
- इसमें एक लंबी, संकरी कांच की नली होती है जिसके एक सिरे पर बल्ब होता है, जिसमें पारा होता है।
- नली के अंदर पारे का एक छोटा, चमकदार धागा दिखाई देता है।
- इसका तापमान पैमाना डिग्री सेल्सियस (°C) में 35°C से 42°C तक होता है।
प्रयोगशाला थर्मामीटर
क्लिनिकल थर्मामीटर के विपरीत, प्रयोगशाला थर्मामीटर की सीमा –10°C से 110°C तक होती है, और इसका उपयोग वैज्ञानिक प्रयोगों में तापमान मापने के लिए किया जाता है।
गैस थर्मामीटर
- लिक्विड-इन-ग्लास थर्मामीटर के विपरीत, जो तरल पदार्थों के अलग-अलग विस्तार गुणों के कारण अलग-अलग रीडिंग दिखाते हैं, गैस थर्मामीटर इस्तेमाल की गई गैस की परवाह किए बिना एक समान रीडिंग प्रदान करते हैं। ऐसा इसलिए है क्योंकि कम घनत्व पर सभी गैसें समान विस्तार व्यवहार प्रदर्शित करती हैं।
आदर्श गैस समीकरण
बॉयल और चार्ल्स के नियमों को मिलाकर, हम आदर्श गैस नियम प्राप्त करते हैं:
PV∝T
या, अपने मानक रूप में:
PV=μRT
जहाँ:
- μ = गैस के मोलों की संख्या
- R = सार्वभौमिक गैस नियतांक = 8.31 J mol⁻¹ K⁻¹
एक नियत-आयतन गैस थर्मामीटर इस सिद्धांत पर निर्भर करता है कि:
P∝T
इसका मतलब है कि नियत आयतन पर, दबाव की निगरानी करके तापमान को मापा जा सकता है।
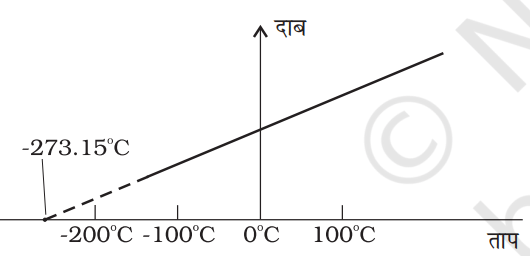
आरेखीय निरूपण
- गैसों के लिए दबाव बनाम तापमान का ग्राफ़ एक सीधी रेखा देता है। जब बहुत कम तापमान पर प्रत्यर्पण किया जाता है, तो दाब सैद्धांतिक रूप से -273.15 डिग्री सेल्सियस पर शून्य हो जाता है।
- इस तापमान को परम शून्य के रूप में जाना जाता है, जो प्रकृति में सबसे कम संभव तापमान है।
तापीय प्रसार
तापीय प्रसार ठोस, द्रव और गैसों की वह प्रवृत्ति है जिसके तहत वे गर्म करने पर फैलते हैं और ठंडा करने पर संकुचित होते हैं। क्योंकि इनमें आणविक गति बढ़ जाती है।
(A) ठोस पदार्थों में प्रसार
- जब ठोस पदार्थों को गर्म किया जाता है, तो उनके परमाणु अधिक कंपन करने लगते हैं, जिससे उनके बीच की दूरी बढ़ जाती है। इसका परिणाम ठोस के प्रसार के रूप में होता है।
- धातुएँ कांच की तुलना में अधिक प्रसारित होती हैं। उदाहरण के लिए, तांबा समान तापमान वृद्धि पर कांच की तुलना में लगभग पाँच गुना अधिक फैलता है।
ठोस पदार्थों में विस्तार के प्रकार:
रैखिक प्रसार (लंबाई में वृद्धि)
- उदाहरण: गर्म करने पर धातु की छड़ का फैलना।
- यह एक विमीय ऊष्मीय प्रसार है।
- सूत्र:
ΔL=L0αΔT
जहाँ:
- ΔL= लंबाई में परिवर्तन
- L0 = प्रारंभिक लंबाई
- α = रैखिक प्रसार गुणांक
- ΔT = तापमान में परिवर्तन
क्षेत्र प्रसार (क्षेत्र में वृद्धि)
- उदाहरण: धातु की प्लेट का दो आयामों में फैलना।
- यह द्विविमीय प्रसार है।
- सूत्र:
ΔA=A0βΔT
- जहाँ β = क्षेत्रीय प्रसार गुणांक
- नोट: β=2α (चूँकि क्षेत्र प्रसार, रैखिक प्रसार का दोगुना है)।
आयतन प्रसार (आयतन में वृद्धि)
- उदाहरण: लोहे के ब्लॉक, कांच की बोतलें सभी दिशाओं में फैलती हैं।
- सूत्र:
ΔV=V0γΔT
जहाँ γ = आयतन प्रसार गुणांक (γ or αv)
- लम्बाइ l के किसी घन (Cube) में तापमान में वृद्धि होने पर सभी दिशाओं में सामान रूप से वृद्धि होती है तब
- नोट: एकसमान रूप से प्रसारित होने वाले भुजा l के घन के लिए:
γ=3α
(क्योंकि आयतन प्रसार रैखिक प्रसार का तीन गुना होता है।)
ऊष्मीय प्रसार गुणांकों में संबंध
- जिस पदार्थ के लिए α, β या y के मान ज्यादा हो उनमें ऊष्मीय प्रसार भी ज्यादा होता है।
- α: β: γ = 1:2:3
- रेखीय प्रसार गुणांक (α) का संबंध: β=2α (क्योंकि क्षेत्रफल दो आयामों में फैलता है)
- आयतन प्रसार गुणांक (γ) का संबंध: γ=3α (क्योंकि आयतन तीन आयामों में फैलता है)
ठोस पदार्थों में तापीय प्रसार के अनुप्रयोग:
- गर्मियों में पटरियों के मुड़ने से बचाने के लिए रेलवे पटरियों के बीच अंतराल छोड़ा जाता है।
- धातु पुलों (Metal Bridges) में प्रसार के लिए प्रसार जोड़ (Expansion Joints) होते हैं।
- बिजली के पोल पर तार बाँधते समय उन्हें कुछ ढीला रखा जाता है।
- काँच की बोतलों में धातु के ढक्कनों को निकालने के लिए उन्हें हल्के गर्म पानी में रखने पर वे खुल जाते हैं, क्योंकि धातु का प्रसार काँच की अपेक्षा अधिक होता है।
- दो धातुओं से बनी द्विधात्विक पट्टियाँ थर्मोस्टैट में उपयोग की जाती हैं।
(B) द्रव पदार्थों में प्रसार
- द्रव ठोस पदार्थों की तुलना में अधिक फैलते हैं क्योंकि अंतर-आणविक बल कमज़ोर होते हैं। द्रवों में केवल आयतन प्रसार होता है।
द्रव पदार्थों में तापीय प्रसार के अनुप्रयोग:
- एल्कोहोल और पारा थर्मामीटर द्रव पदार्थ के प्रसार के कारण काम करते हैं।
- प्रसार के कारण केतली में गर्म पानी ऊपर उठता है।
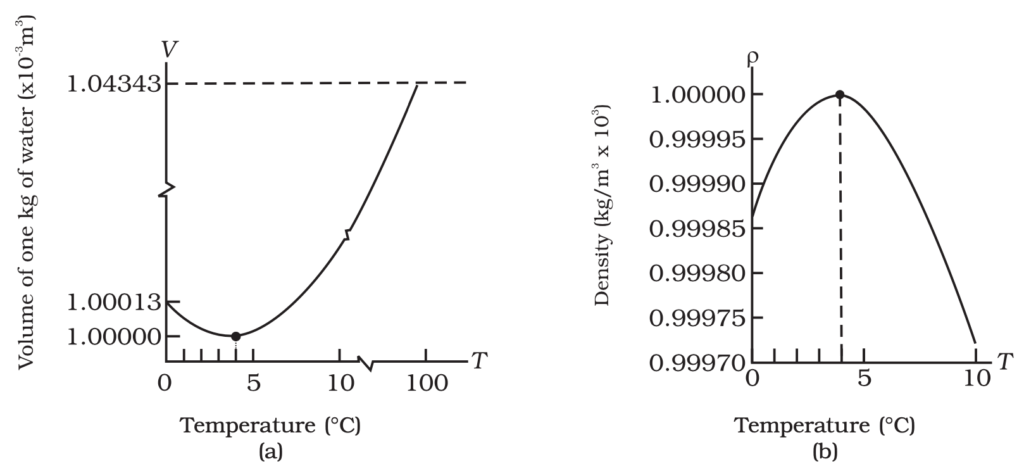
पानी का विसंगत प्रसार
- पानी का असामान्य प्रसार पानी के असंगत व्यवहार को संदर्भित करता है जिसमें 4°C से 0°C तक ठंडा होने पर यह सिकुड़ने के बजाय फैलता है। अधिकांश पदार्थ ठंडा होने पर सिकुड़ते हैं, लेकिन पानी 4°C पर अपने अधिकतम घनत्व पर पहुँच जाता है और फिर ठंडा होने पर फैलता है।
अनुप्रयोग
- यह गुण झीलों और तालाबों को नीचे से जमने से रोकता है, जिससे जलीय जीवन सुरक्षित रहता है।
- इससे हिमखंड तैरने लगते हैं।
पानी का विसंगत प्रसार जलीय जीवन के लिए महत्वपूर्ण है। जब ठंडे क्षेत्रों में सतही पानी 4°C तक पहुँचता है, तो यह अपनी अधिक घनता के कारण नीचे की ओर डूब जाता है, और गर्म पानी ऊपर की ओर उठता है। यह प्रक्रिया तब तक जारी रहती है जब तक सभी पानी का तापमान 4°C तक नहीं पहुँच जाता।
यदि तापमान और गिरता है, तो ऊपर की परत 4°C से नीचे ठंडी होकर विस्तृत होती है और कम घनी हो जाती है, जिसके परिणामस्वरूप सतह पर बर्फ बन जाती है। यह बर्फ की परत नीचे के पानी को जमने से रोकती है और जमी हुई सतह के नीचे जीवन को जारी रखने की अनुमति देती है।
तथ्य
- जल का आयतन न्यूनतम 4ºc पर होता है।
- जल का घनत्व अधिकतम 4ºc पर होता है।
- बर्फ का आयतन जल से ज्यादा होता है।
- बर्फ का घनत्व जल से कम होता है।
- शुद्ध जल की बर्फ का घनत्व जल के घनत्व का 9/10वाँ भाग होता है।
- शुद्ध जल में बर्फ का 90% भाग पानी के अंदर और 10% भाग पानी के बाहर रहता है।
(C) गैसों में प्रसार
- गैसें सबसे अधिक प्रसार करती हैं क्योंकि उनके अणु स्वतंत्र रूप से गति करते हैं।
- प्रसार चार्ल्स के नियम का पालन करता है::
V∝T
(नियत दाब पर, तापमान के साथ आयतन बढ़ता है।)
नियत दाब पर एक आदर्श गैस के लिए:
αv=1/T
गैसों में तापीय प्रसार के अनुप्रयोग:
- गर्म हवा के गुब्बारे ऊपर उठते हैं क्योंकि गर्म हवा विस्तृत होकर हल्की हो जाती है।
- कार के टायर गर्मियों में फैलते हैं, जिससे दाब बढ़ता है।
तापीय प्रतिबल [Thermal stress]
- यदि किसी पदार्थ को गर्म होने पर फैलने से रोका जाता है, तो तापीय प्रतिबल विकसित होता है। यह प्रतिबल इस प्रकार दिया जाता है:
तापीय प्रतिबल = Y×αL×ΔT
जहाँ Y = यंग प्रत्यास्था गुणांक
उदाहरण के लिए, गर्म मौसम में स्टील की पटरिया विस्तारित होती हैं, और यदि इन्हें प्रसार करने के लिए जगह नहीं दी जाती, तो ये बड़ी ताकतें उत्पन्न करती हैं जो मोड़ने का कारण बन सकती हैं।
विशिष्ट ऊष्मा धारिता
विशिष्ट ऊष्मा धारिता किसी पदार्थ के 1 किग्रा के तापमान को 1 K तक बढ़ाने के लिए आवश्यक ऊष्मा की मात्रा है। यह पदार्थ की प्रकृति, द्रव्यमान और उसके तापमान पर निर्भर करता है।
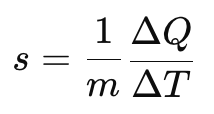
विशिष्ट ऊष्मा धारिता की SI इकाई J kg⁻¹ K⁻¹ है।
मोलर विशिष्ट ऊष्मा धारिता
द्रव्यमान का उपयोग करने के बजाय, हम ऊष्मा धारिता को मोल (μ) के संदर्भ में व्यक्त कर सकते हैं:
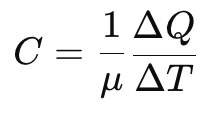
जहाँ C मोलर विशिष्ट ऊष्मा धारिता है, जिसे किसी पदार्थ के एक मोल के तापमान को 1 K तक बढ़ाने के लिए आवश्यक ऊष्मा की मात्रा के रूप में परिभाषित किया गया है। SI इकाई J mol⁻¹ K⁻¹ है।
गैसों की विशिष्ट ऊष्मा धारिता
गैसों के लिए, मोलर विशिष्ट ऊष्मा धारिता को परिभाषित करने के लिए अतिरिक्त स्थितियों की आवश्यकता होती है:
- At constant volume (Cv): When the gas is heated while keeping its volume constant.
- नियत दाब पर (Cp): जब गैस को उसके दाब को नियत रखते हुए गर्म किया जाता है।
- नियत आयतन पर (Cv): जब गैस को उसके आयतन को नियत रखते हुए गर्म किया जाता है।
विशिष्ट ऊष्मा धारिता का महत्व
- सामान्य पदार्थों में पानी की विशिष्ट ऊष्मा धारिता सबसे अधिक होती है।
- इस कारण, पानी का उपयोग ऑटोमोबाइल रेडिएटर में शीतलक के रूप में और गर्म पानी की थैलियों में हीटिंग माध्यम के रूप में किया जाता है।
- धातुओं की विशिष्ट ऊष्मा क्षमता कम होती है, इसलिए वे जल्दी गर्म होकर ठंडी हो जाती हैं।
- तटीय क्षेत्रों में, गर्मियों में पानी ज़मीन की तुलना में अधिक धीरे-धीरे गर्म होता है, जिससे ठंडी समुद्री हवाएँ चलती हैं।
- रेगिस्तानों में, ज़मीन दिन के दौरान तेज़ी से गर्म होती है और रात में अपनी कम विशिष्ट ऊष्मा क्षमता के कारण तेज़ी से ठंडी हो जाती है, जिससे तापमान में अत्यधिक बदलाव होता है।
कैलोरीमेट्री/ऊष्मामिति: ऊष्मा का मापन
ऊष्मामिति का अर्थ ऊष्मा मापन है। किसी निकाय को वियुक्त निकाय तब कहा जाता है जब उस निकाय तथा उसके परिवेश के बीच कोई ऊष्मा विनिमय अथवा ऊष्मा स्थानांतर नहीं होता। कैलोरीमेट्री का मूल सिद्धांत यह बताता है कि:
- उच्च ताप की वस्तु की लुप्त ऊष्मा = निम्न ताप की वस्तु द्वारा ऊष्मा लब्धि
- (बशर्ते कि निकाय से ऊष्मा का कोई भाग भी परिवेश में पलायन न करे)।
कैलोरीमीटर का उपयोग ऊष्मा स्थानांतरण को मापने के लिए किया जाता है।
सूत्र:
m1c1ΔT1=m2c2ΔT2
अज्ञात तापमान, द्रव्यमान या विशिष्ट ऊष्माधारिता ज्ञात करने के लिए उपयोग किया जाता है।
कैलोरीमेट्री के अनुप्रयोग
- अज्ञात पदार्थों की विशिष्ट ऊष्माधारिता को मापना।
- अंतिम तापमान निर्धारित करने के लिए गर्म और ठंडे तरल पदार्थों को मिलाना।
अवस्था परिवर्तन : ठोस, द्रव और गैस
अवस्था में परिवर्तन तब होता है जब किसी पदार्थ और उसके परिवेश के बीच ऊष्मा का विनिमय होता है। अवस्था परिवर्तन के समय पदार्थ के अणुओं के मध्य गतिज ऊर्जा नहीं बदलती, जबकि अणुओं की आंतरिक स्थितिज ऊर्जा में परिवर्तन होता है। मुख्य चरण परिवर्तन में शामिल हैं:
| स्थिति का परिवर्तन | परिभाषा | उदाहरण |
| गलन | ठोस → द्रव | 0°C पर बर्फ का पानी में पिघलना। |
| जमना (ठोस होना) | द्रव → ठोस | 0°C पर पानी का बर्फ में जमना। |
| वाष्पीकरण | द्रव → गैस | 100°C पर पानी का उबालना। |
| संघनन | गैस → द्रव | ठण्डी बोतल पर बनती पानी की बूंदें। |
| ऊर्ध्वपातन | ठोस → गैस (द्रव बने बिना) | सूखी बर्फ (ठोस CO₂) का वाष्प में बदलना। |
गलन और हिमीकरण [जमना]
- गलनांक: वह तापमान जिस पर कोई पदार्थ तापीय संतुलन में ठोस से तरल में परिवर्तित होता है। वह ताप जिस पर किसी पदार्थ की ठोस तथा द्रव अवस्थाएँ परस्पर तापीय साम्य में होती हैं उसे उस पदार्थ का गलनांक कहते हैं।
- हिमीकरण – जब पदार्थ की द्रव अवस्था कुछ ऊष्मा उत्सर्जित कर ठोस अवस्था में परिवर्तित होती है इसे हिमन कहते हैं।
पुनर्हिमायन (Regelation): दाब के कारण गलन
- यदि एक धातु की तार, जिस पर भारी भार लटका हो, बर्फ की पट्टी पर रखी जाए, तो तार के नीचे स्थित बर्फ बढ़े हुए दाब के कारण पिघलने लगती है। हालाँकि, जैसे ही तार आगे बढ़ती है, पिघला हुआ जल पुनः जमकर बर्फ में परिवर्तित हो जाता है। इस प्रक्रिया को पुनर्हिमायन (Regelation) कहा जाता है।
- उदाहरण: हिम पर स्केटिंग
- स्केट के दबाव के कारण बर्फ की एक पतली परत पिघल जाती है, जिससे जल की एक पतली परत बनती है। यह परत एक स्नेहक (lubricant) की तरह कार्य करती है, जिससे स्केटिंग सुगमता से संभव हो पाती है।
वाष्पीकरण (Boiling) और संघनन (Condensation)
- क्वथनांक: वह तापमान, जिस पर कोई तरल अपने परिवेश के साथ तापीय साम्य में रहते हुए गैस में परिवर्तित हो जाता है, उसे क्वथनांक कहा जाता है।
- संघनन: यह वाष्पीकरण की विपरीत प्रक्रिया है, जिसमें कोई गैस शीतलन के कारण पुनः द्रव में परिवर्तित हो जाती है।
- क्वथनांक पर किसी पदार्थ की द्रव तथा वाष्प दोनों अवस्थाएँ तापीय साम्य में परस्पर सहवर्ती होती हैं।
क्वथनांक पर दाब का प्रभाव
- उच्च दाब क्वथनांक को बढ़ाता है।
- उदाहरण: प्रेशर कुकर में भाप बंद हो जाती है, जिससे कुकर के अंदर का दाब बढ़ जाता है। इससे जल का क्वथनांक 100°C से बढ़कर लगभग 120°C तक पहुँच जाता है। उच्च तापमान पर भोजन तेजी से पकता है। यह समय और ऊर्जा दोनों की बचत करता है। पोषक तत्वों की अधिकतम सुरक्षा होती है, जिससे भोजन अधिक स्वास्थ्यवर्धक रहता है।
- कम दाब से क्वथनांक कम हो जाता है।
- उदाहरण: उच्च ऊंचाई वाले क्षेत्रों में खाना पकाना मुश्किल होता है क्योंकि वायुमंडलीय दाब कम होता है, जिससे पानी कम तापमान पर उबलता है
उर्ध्वपातन: ठोस से सीधे गैस में परिवर्तन
कुछ पदार्थ तरल अवस्था से गुजरे बिना सीधे ठोस से गैस में परिवर्तित हो सकते हैं।
- उदाहरण: सूखी बर्फ (ठोस CO₂) और आयोडीन।
गुप्त ऊष्मा: अवस्था परिवर्तन के दौरान ऊष्मा
जब कोई पदार्थ अपनी अवस्था बदलता है (ठोस से द्रव, द्रव से गैस, आदि), तो एक निश्चित मात्रा में ऊष्मा ऊर्जा या तो अवशोषित हो जाती है या बिना तापमान बदले निकल जाती (उत्सर्जित) है। इस ऊष्मा को गुप्त ऊष्मा कहते हैं।
- गुप्त ऊष्मा (L): किसी पदार्थ की अवस्था परिवर्तन के लिए प्रति इकाई द्रव्यमान में आवश्यक ऊष्मा ऊर्जा की मात्रा।
सूत्र:
Q=mL
जहाँ:
- Q = अवशोषित/मुक्त ऊष्मा (जूल)
- m = पदार्थ का द्रव्यमान (किलोग्राम)
- L = गुप्त ऊष्मा (जूल/किलोग्राम)
गुप्त ऊष्मा के प्रकार
- गलन की गुप्त ऊष्मा (Lf) – किसी ठोस के 1 किलोग्राम को बिना तापमान बदले द्रव में परिवर्तन के लिए आवश्यक ऊष्मा।
Q=mLf
उदाहरण: जल (पानी) के लिए Lf = 3.33 × 10⁵ J/kg →
यह दर्शाता है कि 0°C पर 1 kg बर्फ को द्रव में बदलने के लिए 3.33 × 10⁵ J ऊष्मा की आवश्यकता होती है।
- वाष्पन की गुप्त ऊष्मा (Lv) – तापमान में परिवर्तन के बिना 1 किलोग्राम द्रव को गैस में परिवर्तन के लिए आवश्यक ऊष्मा।
Q=mLv
उदाहरण: जल के लिए Lv = 22.6 × 10⁵ J/kg →
इसका अर्थ है कि 100°C पर 1 किलोग्राम जल को भाप में बदलने के लिए 22.6 × 10⁵ J ऊष्मा की आवश्यकता होती है।
भाप से होने वाले जलन उबलते जल से अधिक घातक क्यों होती है?
- भाप में अतिरिक्त गुप्त ऊष्मा होती है (वाष्पीकरण के दौरान संचित ऊष्मा ऊर्जा)। जब भाप त्वचा को स्पर्श करती है, तो यह संघनित होकर जल में परिवर्तित होती है और इस अतिरिक्त ऊष्मा को मुक्त कर देती है, जिससे गम्भीर दाह उत्पन्न होता है।
ऊष्मा संचरण: ऊष्मा का गमन
ऊष्मा एक ऊर्जा संचरण प्रक्रिया है, जो दो निकायों के तापान्तर के कारण होती है। यह मुख्य रूप से तीन प्रकार से होती है:
1. चालकता/चालन (Conduction) – ठोसों में ऊष्मा संचरण
चालन अणुओं के बीच सीधे संपर्क के माध्यम से ऊष्मा स्थानांतरण की प्रक्रिया है, जिसमें पदार्थ की स्वयं की गति नहीं होती। यह ठोस, तरल और गैसों में होता है, लेकिन ठोस पदार्थों में सबसे तेज़ होता है।
उदाहरण: यदि धातु की छड़ का एक सिरा लौ में रखा जाता है, तो ऊष्मा गर्म सिरे से ठंडे सिरे तक जाती है, जिससे अंततः पूरी छड़ गर्म हो जाती है।
- ठोस पदार्थ ऊष्मा के सबसे अच्छे संवाहक होते हैं क्योंकि उनके अणु एक दूसरे से बहुत नजदीक होते हैं।
- द्रवों में मध्यम चालकता होती है, जबकि गैसें खराब चालक होती हैं क्योंकि उनके अणु एक दूसरे से बहुत दूर होते हैं।
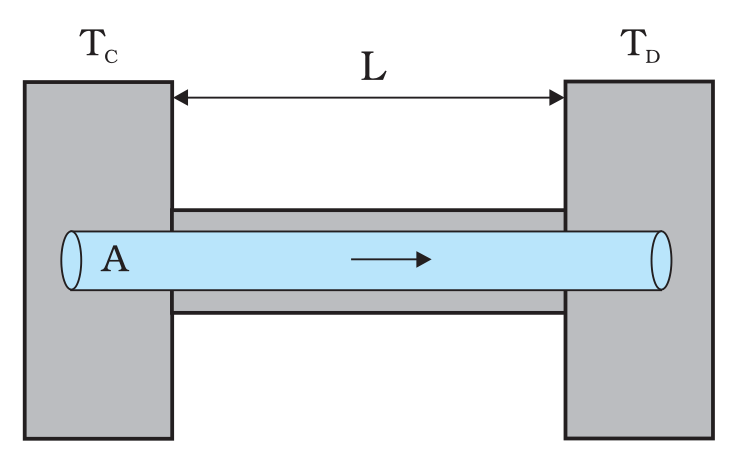
किसी पदार्थ के माध्यम से ऊष्मा प्रवाह (H) की दर फूरियर के नियम द्वारा दी गई है: “किसी पदार्थ के माध्यम से ऊष्मा प्रवाह की दर तापमान प्रवणता और पदार्थ की ऊष्मा चालकता के सीधे आनुपातिक होती है।”
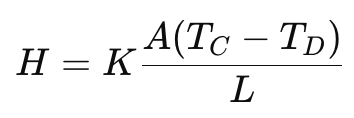
जहाँ:
- H = ऊष्मा प्रवाह दर (W या J/s)
- K = ऊष्मा चालकता (W/m·K) – आनुपातिक स्थिरांक
- A = पदार्थ का अनुप्रस्थ-काट क्षेत्रफल (m²)
- L = पदार्थ की लंबाई (m)
- TC =उच्च तापमान (°C या K)
- TD = निम्न तापमान (°C या K)
इस प्रकार, अधिक ऊष्मा प्रवाह होती है जब:
- तापान्तर अधिक होता है।
- पदार्थ में उच्च ऊष्मा चालकता होती है (K का मान हो)।
- अनुप्रस्थ-काट क्षेत्रफल (A) बड़ा होने पर, ऊष्मा के प्रवाह के लिए अधिक सतह उपलब्ध होती है।
- कम ऊष्मा प्रवाह होती है जब:
- लंबाई (L) अधिक होती है, क्योंकि ऊष्मा को लंबी दूरी तय करनी पड़ती है।
ऊष्मीय चालकता (K): किसी पदार्थ की ऊष्मा संचालित करने की क्षमता
विभिन्न पदार्थों की ऊष्मा संचालित करने की क्षमता अलग-अलग होती है। धातुओं की ऊष्मा चालकता अधिक होती है, जबकि उष्मारोधी (insulators) की ऊष्मा चालकता कम होती है।
- धातु (तांबा, चांदी, एल्युमीनियम) उत्कृष्ट ऊष्मा चालक होते हैं।
- लकड़ी, प्लास्टिक और कांच तंतु कमजोर ऊष्मा चालक होते हैं, अर्थात् वे उष्मारोधी (insulators) होते हैं।
- वायु सर्वोत्तम उष्मारोधी में से एक है, इसलिए ऊष्मारोधी (thermal insulation) सामग्री वायु को फँसाकर रखती हैं।
चालन (Conduction) के अनुप्रयोग
| रसोई के बर्तन | अच्छे ऊष्मा चालक होने के कारण, तांबा या एल्युमीनियम बर्तन के तले में ऊष्मा का समान वितरण सुनिश्चित करते हैं, जिससे भोजन समान रूप से पकता है। |
| गर्मियों में धातु की छतें | गर्मियों में धातु की छतें ऊष्मा अवशोषित करके उसे अंदर स्थानांतरित कर देती हैं, जिससे घर अधिक गर्म हो जाते हैं। |
| छत का रोधन | छतों पर फोम की परतें गर्मियों में घर को ठंडा रखने में मदद करती हैं, क्योंकि वे ऊष्मा के चालन को रोकती हैं। |
| दोहरी परत वाली खिड़कियां | कांच की परतों के बीच हवा फँसाता है, जिससे ऊष्मा चालन कम हो जाता है। |
| कपड़ों में ऊष्मा रोधन | ऊन और सिंथेटिक रेशे हवा को फंसा कर शरीर की ऊष्मा को बाहर निकलने से रोकते हैं, जिससे गर्मी बनी रहती है। |
| रेडिएटर में कूलिंग फिन्स | कार इंजन में उपयोग किए जाने वाले कूलिंग फिन्स सतह क्षेत्र (surface area) को बढ़ाते हैं, जिससे ऊष्मा तेजी से नष्ट होती है और इंजन अधिक ठंडा रहता है। |
2. संवहन (तरल पदार्थ – द्रव और गैसों में ऊष्मा स्थानांतरण)
संवहन ऊष्मा स्थानांतरण की वह विधि है जो पदार्थ की वास्तविक गति के माध्यम से तरल पदार्थ (द्रव और गैस) में होता है।
प्राकृतिक संवहन कैसे काम करता है
- जब किसी तरल को नीचे से गर्म किया जाता है, तो वह फैलता है, उसका घनत्व घट जाता है, और वह ऊपर उठता है।
- तरल पदार्थ का ठंडा, सघन हिस्सा ऊपर उठते गर्म तरल पदार्थ को प्रतिस्थापित करने के लिए नीचे चला जाता है।
- यह चक्र जारी रहता है, जिससे एक संवहन धारा बनती है जो ऊष्मा स्थानांतरित करती है।
संवहन के प्रकार:
- प्राकृतिक संवहन – घनत्व अंतर के कारण होता है।
- उदाहरण: गर्म हवा ऊपर उठती है और ठंडी हवा नीचे आती है, जिससे वायु धाराएँ बनती हैं।
- उदाहरण: समुद्री समीर (Sea Breeze) और स्थल समीर (Land Breeze) भूमि और जल के भिन्न ऊष्मीय गुणों के कारण उत्पन्न होती है।
- प्रणोदित संवहन – यह पंखों (fans) या पंपों (pumps) की सहायता से उत्पन्न किया जाता है।
- उदाहरण: मानव परिसंचरण तंत्र, जहाँ हृदय शरीर के तापमान को नियंत्रित करने के लिए रक्त पंप करता है।
- उदाहरण: ऑटोमोबाइल कूलिंग सिस्टम, जहाँ एक पंखा इंजन की गर्मी को दूर करने के लिए शीतलक प्रसारित करता है।
न्यूटन का शीतलन नियम
“किसी पिंड की ऊष्मा क्षय की दर पिंड और उसके परिवेश के बीच तापो के अंतर के सीधे अनुक्रमानुपाती होती है, बशर्ते लघु तापान्तर हो।”
गणितीय निरूपण
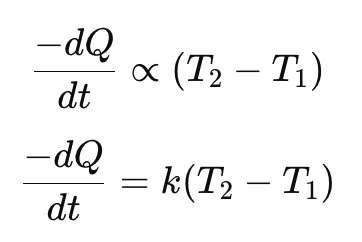
जहाँ:
- dQ/dt = ऊष्मा क्षय की दर
- T₂ = वस्तु का तापमान
- T₁ = परिवेश का तापमान
- k = नियतांक (वस्तु के सतह क्षेत्र और प्रकृति पर निर्भर करता है)
T₂ के लिए हल:
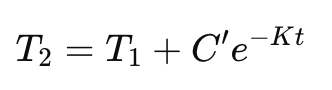
जहाँ C’ एक नियतांक है।
अनुप्रयोग: गर्म पेय को ठंडा करना → चाय या कॉफ़ी शुरू में तेज़ी से ठंडी होती है, फिर धीमे धीमे।
संवहन के उदाहरण
| गर्म हवा के गुब्बारे | गुब्बारे के अंदर की गर्म हवा हल्की हो जाती है, जिससे वह ऊपर उठ जाता है। |
| व्यापारिक हवाएँ | वैश्विक संवहनीय धाराएँ, पृथ्वी के घूर्णन गति के कारण लगातार उत्तर-पूर्व दिशा से विषुवत रेखा की ओर चलने वाली स्थायी पवनें उत्पन्न करती हैं। |
| समुद्र समीर | दिन के समय, भूमि जल की तुलना में अधिक तेजी से गर्म हो जाती है। भूमि की गर्म हवा फैलती है, हल्की हो जाती है और ऊपर उठती है। समुद्र की अपेक्षाकृत ठंडी और घनी हवा भूमि की ओर प्रवाहित होती है, जिससे समुद्र समीर बनती है। |
| स्थल समीर | रात्रि के समय, भूमि जल की तुलना में अधिक तेजी से ठंडी हो जाती है। समुद्र का जल अपेक्षाकृत गर्म रहता है, जिससे वहाँ की हवा गर्म होकर ऊपर उठती है।ठंडी और घनी भूमि की हवा समुद्र की ओर प्रवाहित होती है, जिससे स्थल समीर (Land Breeze) बनती है। |
3. विकिरण (बिना माध्यम के ऊष्मा स्थानांतरण)
विकिरण विद्युत चुम्बकीय तरंगों के रूप में ऊष्मा का स्थानांतरण है, जिसके लिए किसी माध्यम की आवश्यकता नहीं होती।
उदाहरण: सूर्य की ऊष्मा, विकिरण के माध्यम से अंतरिक्ष से होकर पृथ्वी तक पहुँचती है, क्योंकि अंतरिक्ष एक निर्वात है।
विकिरण ऊष्मा के गुण
- यह तरंगों के रूप में प्रकाश की गति (3 × 10⁸ m/s) से यात्रा करता है।
- सभी वस्तुएँ ऊष्मा का विकिरण उत्सर्जित (emit) करती हैं।
- ऊष्मा स्थानांतरण के लिए वस्तुओं के बीच सीधे संपर्क की आवश्यकता नहीं होती।
ऊष्मीय विकिरण
किसी पिंड द्वारा उसके तापमान के कारण उत्सर्जित ऊष्मा विकिरण को ऊष्मीय विकिरण कहते हैं। उदाहरण:
- लाल-गर्म लोहा (Red-hot iron) ऊष्मा के कारण चमकता है।
- बिजली के बल्ब का फिलामेंट प्रकाश और ऊष्मा दोनों उत्सर्जित करता है।
स्टीफन-बोल्ट्ज़मान नियम
“”किसी कृष्णिका के प्रति इकाई सतह क्षेत्र में विकीर्ण की गई कुल ऊष्मा ऊर्जा उसके परम तापमान की चौथी घात के समानुपाती होती है।”
E = σT4
जहाँ:
- E = विकिरित ऊर्जा
- σ = स्टीफन-बोल्ट्ज़मैन नियतांक (5.67×10-8 W/m²·K⁴)
- T = तापमान (केल्विन)
कृष्णिका विकिरण:
- कृष्णिका/कृष्ण पिंड अपने उपर आपतित संपूर्ण विकिरणों को पूर्णतः अवशोषित कर लेती है और अधिकतम विकिरण उत्सर्जित करती है।
- गहरे रंग की सतहें हल्के रंग की सतहों की तुलना में अधिक गर्मी अवशोषित करती हैं।
किरचॉफ का नियम
इसके अनुसार “अच्छे अवशोषक ही अच्छे उत्सर्जक होते हैं तथा बुरे अवशोषक बुरे उत्सर्जक होते हैं”
- हल्के रंगो की वस्तुओं की अपेक्षा काले रंग की वस्तुएँ विकिरण ऊर्जा का अवशोषण तथा उत्सर्जन अधिक करती है।
- उदाहरण- भैस को गर्मी में ज्यादा गर्मी लगती है एवं सर्दी में ज्यादा ठंड लगती है।
यदि अँधेरे में एक काली एवं सफेद वस्तु को समान ताप पर गर्म करके रख दिया जाये तो किरचॉफ नियम के अनुसार अँधेरे में काली वस्तु अधिक चमेकगी।
विकिरण के अनुप्रयोग
| गर्मी में सफेद/हल्के रंग के कपड़े पहनना | हल्के रंग अधिक ऊष्मा परावर्तित करते हैं, जिससे शरीर ठंडा रहता है। |
| सर्दी में गहरे रंग के कपड़े पहनना | गहरे रंग अधिक ऊष्मा अवशोषित करते हैं, जिससे शरीर गर्म रहता है। |
| काले तले वाले खाना पकाने के बर्तन | काले रंग की सतह ऊष्मा अधिक अवशोषित करती है, जिससे खाना तेजी से पकता है। |
| सौर कुकर और सौर पैनल | काली सतहें अधिकतम सौर विकिरण को अवशोषित करती हैं और अधिक ऊष्मा उत्पन्न करती हैं। |
थर्मस फ्लास्क
थर्मस फ्लास्क को चालन, संवहन और विकिरण को कम करके ऊष्मा क्षय को कम करने के लिए डिज़ाइन किया गया है।
थर्मस फ्लास्क की संरचना
- दोहरी दीवार वाला कांच का बर्तन: चालन को कम करता है।
- दीवारों के बीच निर्वात: संवहन को रोकता है।
- आंतरिक और बाहरी दीवारों पर चाँदी का लेप: विकिरण को वापस फ्लास्क में परावर्तित करता है।
- कॉर्क या प्लास्टिक स्टॉपर: चालन को अवरुद्ध करने के लिए एक उष्मारोधी/इन्सुलेटर के रूप में कार्य करता है।
यह कैसे काम करता है:
- गर्म तरल पदार्थ को गर्म रखता है क्योंकि ऊष्मा बाहर नहीं निकल पाती। [ऊष्मा क्षय रोक कर]
- ठंडे तरल पदार्थ को ठंडा रखता है क्योंकि बाहरी ऊष्मा अंदर प्रवेश नहीं कर पाती।
ऊष्मागतिकी के नियम
यांत्रिकी ऊर्जा और ऊष्मा में संबंध का अध्ययन ऊष्मा गतिकी कहलाती है। ऊष्मा गतिकी भौतिकी की वह शाखा है, जो ऊष्मा तथा ताप की अवधारणा एवं ऊष्मा के अन्य प्रकार की ऊर्जाओं में रूपांतरण का विवेचन करती है।
1. ऊष्मागतिकी का शून्य कोटि नियम (Zeroth Law of Thermodynamics) – तापीय संतुलन का नियम
नियम: “यदि दो निकाय (A और B) प्रत्येक तीसरे निकाय (C) के साथ तापीय साम्य में हैं, तो A और B भी परस्पर तापीय साम्य में होते हैं।” स्पष्टीकरण:
- यह नियम विधिवत ताप और तापीय संतुलन/तापीय साम्य की अवधारणा को स्थापित करता है।
- यह दर्शाता है कि तापमान एक मौलिक और मापन योग्य गुणधर्म है।
- इससे तापमान मापन के लिए स्केल (जैसे सेल्सियस और केल्विन) परिभाषित किए जाते हैं।
2. ऊष्मागतिकी का प्रथम नियम (First Law of Thermodynamics) – ऊर्जा संरक्षण का नियम
नियम:
“ऊर्जा को न तो उत्पन्न किया जा सकता है और न ही नष्ट किया जा सकता है, केवल इसे एक रूप से दूसरे रूप में बदला जा सकता है।”
गणितीय रूप:
ΔU=Q−W
जहाँ:
- ΔU = आंतरिक ऊर्जा में परिवर्तन
- Q = परिवेश द्वारा निकाय को दी गई ऊष्मा
- W = निकाय द्वारा परिवेश पर किया गया कार्य
व्याख्या:
- जब किसी निकाय को ऊष्मा दी जाती है, तो उसकी आंतरिक ऊर्जा बढ़ती है।
- जब कोई निकाय अपने परिवेश पर कार्य (W) करता है, तो उसकी आंतरिक ऊर्जा कम होती है।
- यह सिद्धांत ऊष्मा इंजन, रेफ्रिजरेटर और रासायनिक अभिक्रियाओं का आधार है।
3. ऊष्मागतिकी का द्वितीय नियम (Second Law of Thermodynamics) – एंट्रॉपी का नियम
- केल्विन-प्लैंक प्रकथन – ऊष्मा इंजन नियम
ऐसा कोई प्रक्रम संभव नहीं है, जिसका परिणाम केवल किसी ऊष्मा भंडार से ऊष्मा का अवशोषण करके उसे पूर्णतया कार्य में रूपांतरित करता है। इसे ‘केल्विन प्लैंक’ प्रकथन कहते हैं।
“कोई भी ऊष्मा इंजन संपूर्ण ऊष्मा ऊर्जा को उपयोगी कार्य में परिवर्तित नहीं कर सकता, बिना कुछ ऊर्जा को अपशिष्ट ऊष्मा के रूप में गँवाए।”
→ इसका अर्थ है कि ऊष्मा इंजनों में 100% दक्षता असंभव है, क्योंकि कुछ ऊर्जा हमेशा परिवेश में अपशिष्ट ऊष्मा के रूप में नष्ट हो जाती है।
- क्लॉसियस प्रकथन – ऊष्मा प्रवाह नियम
“बाहरी कार्य के बिना ऊष्मा स्वतः ही ठंडे पिंड से गर्म पिंड में प्रवाहित नहीं हो सकती।”
→ यह बताता है कि रेफ्रिजरेटर को बिजली की आवश्यकता क्यों होती है – इसे ठंडे क्षेत्र (फ्रिज के अंदर) से गर्म क्षेत्र (बाहर) में ऊष्मा ले जाने के लिए ऊर्जा की आवश्यकता होती है।
गणितीय रूप (क्लॉसियस असमानता):
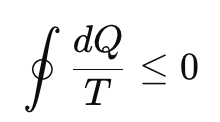
जहाँ dQ ऊष्मा स्थानांतरण है और T केल्विन में तापमान है।
- एंट्रॉपी (Entropy) का प्रकथन: (अव्यवस्था प्रकथन)
“एक पृथक प्रणाली (Isolated System) में कुल एंट्रॉपी (अव्यवस्था) समय के साथ बढ़ती रहती है और कभी कम नहीं होती।”
→ निकाय स्वाभाविक रूप से अधिक अव्यवस्थित हो जाते हैं (जैसे, बर्फ पिघलती है, वस्तुएँ टूटती हैं, और ऊर्जा फैलती है)।
4. ऊष्मागतिकी का तृतीय नियम (Third Law of Thermodynamics) – परम शून्य और एंट्रॉपी
प्रकथन:
“जब किसी निकाय का तापमान परम शून्य (0 K) के निकट पहुँचता है, तो एक पूर्ण क्रिस्टल की एंट्रॉपी शून्य के बराबर हो जाती है।”
व्याख्या:
- परम शून्य (0 K) पर, सभी आणविक गति सैद्धांतिक रूप से रुक जाती है, जिसका अर्थ है कोई अव्यवस्था (एन्ट्रॉपी) नहीं।
- व्यावहारिक रूप से, परम शून्य (0 K) को पूरी तरह प्राप्त नहीं किया जा सकता, लेकिन वैज्ञानिक इसके बहुत निकट पहुँच सकते हैं।
| नियम | अवधारणा | विवरण |
| शून्यवाँ नियम / शून्य कोटि नियम | तापीय संतुलन / तापीय साम्य | यदि A = C और B = C, तो A = B (तापीय साम्य) |
| प्रथम नियम | ऊर्जा संरक्षण | ΔU=Q−W (ऊर्जा को न उत्पन्न किया जा सकता है और न नष्ट किया जा सकता है) |
| द्वितीय नियम | एंट्रॉपी | ऊष्मा स्वाभाविक रूप से गर्म से ठंडे की ओर प्रवाहित होती है; एंट्रॉपी बढ़ती है। |
| तृतीय नियम | परम शून्य | जब तापमान 0 K के निकट होता है, तो एंट्रॉपी शून्य हो जाती है। |
| हेस का नियम | नियत ऊष्मा योगफल | अभिक्रिया की कुल एन्थैल्पी परिवर्तन एक ही रहता है, चाहे वह एक चरण में हो या कई चरणों में। |
| फुरिए का नियम | चालन | ऊष्मा स्थानांतरण पदार्थ और ताप प्रवणता पर निर्भर करता है। |
| न्यूटन का शीतलन नियम | शीतलन | अधिक तापान्तर होने पर ठंडा होने की गति तेज होती है। |
| स्टीफन-बोल्ट्ज़मान नियम | विकिरण | विकिरित ऊष्मा ∝ T4 होती है |
| प्लांक का नियम | क्वांटम विकिरण | ऊर्जा उत्सर्जन तापमान और तरंगदैर्घ्य पर निर्भर करता है। |
